

이상지질혈증과 심혈관질환
Hypertriglyceridemia and Cardiovascular disease

이상지질혈증 치료 시 가장 먼저 목표로 삼는 것은 LDL-C이다. 환자의 상태에 따라 LDL-C의 치료 목표치가 다양하게 정해져 있고, 이에 따라 치료하는 것이 가장 효과적인 것으로 알려져 있다.
그러나 LDL-C조절만으로 모든 심혈관질환의 발생을 막을 수 없으므로 중성지방이나 HDL-C도 목표치에 따라 조절하고 있다.
스타틴 치료로 심혈관질환의 발생은 25% 정도 감소되는데, 나머지 75%는 당뇨병·비만·높은 중성지방·낮은 HDL-C을 조절하는 것이 필요하다.
미국 등 여러 나라에서 저밀도지단백 콜레스테롤은 감소 추세인데 반해, 중성지방은 증가 추세이어서 국민건강 증진 측면에서 중요성이 더욱 강조되고 있는 경향도 이러한 결론을 반영한다. 이는 주로 비만, 인슐린 저항성, 당뇨병과 대사 증후군 등의 영향에 의해 중성지방이 증가한 것으로 해석된다.
따라서 저밀도지단백 콜레스테롤 조절 이후에도 남아있는 상당 부분의 죽상경화증 잔존위험도를, 중성지방과 고밀도지단백 콜레스테롤 조절을 통해 예방하는 것은 매우 중요한 예방 치료이다.
중성지방의 치료 목표치
중성지방의 목표치는 과거에는 250 mg/dL, 200 mg/dL을 목표로 하였으나 점점 엄격하게 조절할 것을 권장해 150 mg/dL를 목표로 하고 있다. 150 mg/dL 미만은 정상, 150~199 mg/dL는 경계역, 200~499 mg/dL는 높음, 500 mg/dL 이상은 매우 높음으로 분류되고 있다.
우리나라의 경우 일반적으로 200 mg/dL 미만으로 도달할 것을 목표로 하고 있다. 하지만 중성지방 수치 자체보다는 환자들의 심혈관질환 발생 위험군별 non-HDL 콜레스테롤 목표치를 기준으로 조절하는 것이 더 효과적이어서 이를 권유하고 있다.
심혈관질환 발생의 위험인자인 중성지방
이렇게 중성지방이 증가하면 심혈관질환의 위험도 상승하는 사실은 널리 알려져 있는데 과거에는 이에 대해 논란이 많이 제기되곤 했다.
중성지방 측정의 변화량이 다른 콜레스테롤 측정에 비해 커서 민감한 변화를 보이고 있기 때문이며, LDL-C과 HDL-C 의 수치 그리고 혈당 및 비만 정도에 따라서 수치가 변화하고 관상동맥질환 발생 위험도가 다르게 나타났기 때문이다.
중성지방은 식사나 운동·음주 등 생활습관에 따라 단기간에 민감하게 큰 폭으로 변화한다. 이상지질혈증 중에서 고중성지방혈증의 경우, 식이 조절 등 생활습관개선을 중점적으로 관리하는 이유가 여기에 있다.
중성지방이 죽상경화의 중요한 위험인자라는 것은 지난 30년 동안의 논쟁 끝에 내려진 결과이다.
이는 상반된 결과들을 보인 여러 역학 연구들을 모아 메타 분석해 도출한 결과들과, 최근의 대규모 코호트 연구 결과에 근거하여 해석된 것으로서, 저밀도지단백 및 고밀도지단백 콜레스테롤을 함께 고려해 분석할 때 중성지방의 중요도가 커진다.
또한 여러 연구들을 통해 중성지방이 자체적으로 죽상경화를 유발하는 것보다는 다른 지질단백의 구성과 대사에 영향을 미치는 효과를 통해 작용하므로, 죽상경화 발생 위험도의 중요한 표지자로 인식되는 것이 바람직하다.
Triglyceride-Rich Lipoprotein(TRL)의 죽상경화 호발 병태생리 규명, 중성지방 증가에 따른 저밀도지단백 콜레스테롤 및 고밀도지단백 콜레스테롤 입자크기의 변화, 유전적 및 대사 조절 인자의 규명 등을 통해, 고중성지방혈증이 죽상경화의 위험도를 증가시키는 것을 설명하고 있다.
2007년 유럽에서 보고된 대규모 코호트 연구에서 다른 요인을 보정했을 때에도 중성지방은 심혈관질환 발생 위험도를 1.6배 정도 증가시켜서 죽상경화의 궁극적인 위험인자임이 확인된 바 있다. 아시아에서도 이러한 변화 양상은 비슷한 것으로 나타났다(Sarwar N et al. Circulation 2007;115:450-8).
또한, Prospective Cardiovascular M?nster Study에서는 HDL-C이 낮은 환자에서 중성지방이 높을수록 심혈관질환 발생 위험이 높아진다는 것을 보고한 바 있다(Assmann G, Schulte H. Am J Cardiol 1992;70:733-737)<그림 1>.
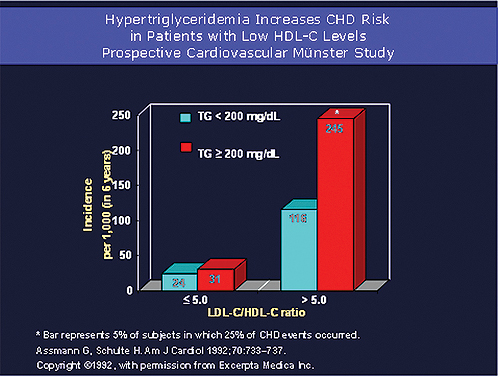
중성지방의 변화는 HDL-C 수치와 역관계를 보이는 경향이 있으므로 중성지방 자체가 HDL-C의 수치 변화를 동반하는 경우가 많다.
중성지방은 대사증후군을 동반한 환자의 심근경색의 발생 요인 중의 하나로 높은 중성지방은 odds ratio가 1.51, 낮은 HDL-C은 1.41로 높은 상관관계가 보고됐다(Ninomiya JK et al. Circulation. 2004;109:42-46). 대사증후군을 동반한 뇌졸중의 경우에는 높은 중성지방이 다른 위험요인에 비해 특히 높은 연관성을 나타낸다(Ninomiya JK et al. Circulation. 2004;109:42-46).
PROVE IT-TIMI 22 study에서는 LDL-C을 70 mg/dL (1.8 mmol/L) 미만으로 적극적으로 치료한 상황에서 중성지방이 심혈관질환 발생에 미치는 영향을 알아보았다.
그 결과, 스타틴요법으로 LDL-C을 70 mg/dL 미만으로 낮춘 환자가 중성지방이 200 mg/dL (2.3 mmol/L)로 상승된 경우, 고중성지방혈증이 없는 환자군에 비해 사망, 심근경색, 급성관상동맥증후군의 발생 위험이 56% 증가했다(Miller M et al. J Am Coll Cardiol 2008;51:724-30).
한편 TNT study에서는 LDL-C을 70 mg/dL (1.8 mmol/L) 미만으로 적극적으로 치료한 경우에도 HDL-C이 낮으면 심혈관질환이 39% 증가돼, 낮은 HDL-C을 대혈관질환의 잔존 위험요인으로 보고했다(Barter P et al. TNT sub-analysis. N Engl J Med 2007;357:1301-10).
중성지방의 대사기전
음식물을 통해 체내로 들어온 중성지방은 대장에서 킬로마이크론 형태로 분비돼 간으로 이동하고 간에서 재합성된 VLDL이 혈액으로 분비되면 혈액 내의 효소 작용을 통해VLDL은 IDL을 거쳐 LDL로 전환돼 이동한다.
이때 대사된 지단백질 중 혈액에 남아있는 지단백질이 산화되고 대식세포에 의해 포획돼 혈관 내막하에 침착되면서 죽상경화증이 발생한다.
죽상동맥경화증 발생기전에 관여하는 요인
▶ LDL-C : 중성지방이 증가하면 small dense LDL이 증가한다. 이러한 Small dense LDL은 산화가 잘되고 혈관 투과율이 높아 내막에 침착이 잘되는 것으로 알려져 있다.
중성지방이 높을 때 small dense LDL이 증가하는 기전은 다음과 같다. 중성지방이 많으면 간에서 큰 입자의VLDL이 형성되고, 혈액에서 활성화된CETP의 매개작용을 통해 VLDL과 LDL, HDL사이에서 콜레스테롤 에스테르와 중성지방을 주고 받는 상호교환이 일어난다.
즉 LDL, HDL의 콜레스테롤 에스테르는 VLDL로 전달되고, VLDL의 중성지방은 LDL과 HDL로 전달된다. 결과적으로 LDL과 HDL의 중성지방 함량이 증가하게 되고, LDL내의 중성지방은 hepatic lipase에 의해 분해돼, 크기가 작고 콜레스테롤 비율이 높은small dense LDL이 많이 생기게 된다.
또한 HDL내의 중성지방이 분해돼 HDL도 크기가 작아지게 되고, 작은 크기의 HDL은 지방 함량이 적은 상태로서 혈액을 순환하다가 간 세포에 쉽게 포획되거나 apoA1만 남은 상태로 신장으로 배설되므로 혈액의 HDL-C 수치는 낮아지게 된다.
Framingham 연구에서, 중성지방의 증가에 따라 LDL-C농도 수치는 완만하게 증가하다가 정점에 도달해 더 이상 증가하지 않지만, LDL 입자 개수는 계속 더 증가하여 추가적인 정점 곡선을 보이는 자료를 보면, 중성지방의 증가에 따라서 small dense LDL이 많이 생성된 결과임을 알 수 있다(Kathiresan S et al. Circulation 2006;113;20-29).
▶ ApoB와 ApoC III : 죽상동맥경화증 발생 기전에 관여하는 위험요인으로 ApoB-48, ApoC III 등이 거론되고 있다.
플라크 콜레스테롤은 ApoB-48과 ApoB-100으로부터 생성되고 이는 죽상동맥경화증을 촉진한다. LDL-C 수치가 동일해도 ApoB가 증가할 경우 죽상동맥경화증이 증가하는 것으로 널리 알려져 있다. 또한 Framingham risk factor가 동일해도 ApoB가 증가할 경우 죽상동맥경화증이 증가하는 것으로 알려져 있다
▶ HDL-C이 미치는 영향 : 낮은 HDL-C (<40 mg/dL)은 높은 중성지방 못지않게 죽상동맥경화증의 위험요인으로 알려져있다(Gordon T et al. Am J Med 1977;62:707-14).
HDL-C이 저하되는 이유로는 중성지방의 상승, 과체중과 비만, 운동 부족, 제2형 당뇨병, 흡연, 탄수화물 섭취 과다, 약물의 복용을 들 수 있으며 이러한 상황들은 동시에 높은 중성지방혈증을 유발한다.
HDL-C의 치료전략으로는 LDL-C을 먼저 치료하고, 체중 감소 및 운동을 통해서 중성지방이 200 mg/dL 이상일 경우에는 non-HDL-C을 치료한다. 그 이후에도 HDL-C이 낮은 경우에는 고위험군의 경우 특히 나이아신과 피브레이트의 약물치료를 적극적으로 고려할 수 있다.
높은 중성지방의 치료
높은 중성지방을 치료할 때에는 중성지방 수치 자체를 치료할 수 있고(150 mg/dL 기준), non-HDL-C을 치료할 수 있는데, 심혈관질환 발생 위험군별로 non-HDL-C은 LDL-C 목표에 30 mg/dL (VLDL, IDL)을 더한 수치를 목표로 잡는다. 중성지방 수치 자체보다는 Non-HDL-C을 기준으로 치료하는 것이 심혈관질환 발생 예방에 더 효과적으로 알려져 있다
Non-HDL-C 목표치는 저위험군 190 mg/dL, 중증등위험군 160 mg/dL, 고위험군 130 mg/dL이다.
즉, 죽상경화증의 원인을 고려할 때, 단순히 중성지방 수치만을 고려할 것이 아니라 식사조절과 운동 등 건강한 생활습관개선을 통해 비만이나 인슐린 저항성 개선과 함께 고중성지방혈증을 개선하는 것이 바람직하다.
중성지방의 측정
중성지방의 측정은 공복 시에 하도록 되어있는데 그 이유는 식사에 따라 변화하는 정도가 급격하기 때문이고 이를 보정하기 위해서 공복 시에 측정할 것을 권고하고 있다.
그러나 최근에는 공복 시에 측정하지 않은 중성지방이 심근경색·허혈성 심질환·사망 등의 위험을 더 잘 대변하는 정확한 지표라는 연구 결과들도 보고되었다. 이는 식후 고혈당·고중성지방혈증과 동반된 염증 반응의 증가가 죽상경화 발생의 중요한 요소라는 동맥경화 연구 결과들과도 일맥상통한다고 할 수 있다.
결론
제2형 당뇨병과 대사증후군의 이상지질혈증은 LDL-C, HDL-C, 중성지방 수치의 이상 소견들이 모두 관여되어 있으며, 최근의 치료에서는 LDL-C 조절이 이루어진 후에는 적극적으로 HDL-C를 높이고, 중성지방을 낮추는 통합적인 이상지질혈증 관리에 관심이 모아지고 있다.
따라서 잔존하는 혈관 위험을 동반한 당뇨병 환자를 치료하기 위해 LDL-C·총 콜레스테롤·당화혈색소·혈압 등 다양한 요인을 복합적으로 조절할 것을 권고하고 있다<그림 2>.
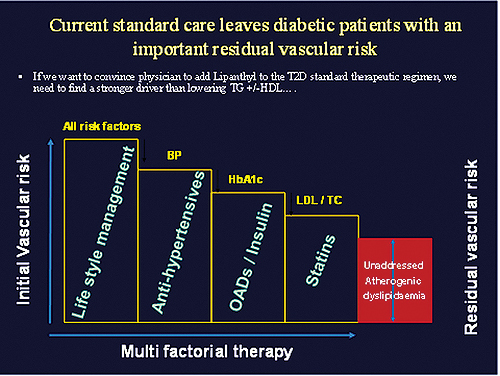
결론적으로 높은 중성지방은 그 자체도 위험요인이지만, 높은 중성지방이 HDL-C, LDL-C, small dense LDL, ApoB-48, ApoB-100에 영향을 미쳐서 죽상동맥경화증의 위험을 증가시켜 죽상동맥경화증의 발생을 촉진한다.
그러므로 환자의 심혈관질환 발생 위험도에 따른 각각의 지질 목표치를 만족하는 통합적·총체적인 이상지질혈증 관리 및 치료가 필요하다.
ACCORD 지질연구와 이전에 시행된 피브레이트 임상연구
ACCORD Lipid and Previous Fibrate Trials

피브레이트 관련 임상연구
현재 이상지질혈증 치료에서 스타틴을 이용한 치료에 집중하고 있는 것은 사실이지만, LDL-C 뿐만 아니라 HDL-C 및 중성지방에도 관심을 기울여야 할 필요성이 차차 부각되는 추세이다.
이에 중성지방을 낮추는데 효율적인 피브레이트를 근간으로 진행된 주요 임상연구를 검토해보고자 한다. 피브레이트와 관련된 임상연구들은 다음과 같다.
|
▶CDP 연구: 클로피브레이트를 사용해 심혈관질환을 예방할 수 있는지를 가늠한 연구이다. 스타틴 제제를 사용하기 전에 시행된 연구이다. ▶VA-HIT 연구: 겜피브로질을 사용해 심혈관질환을 예방할 수 있음을 증명한 획기적인 연구(landmark study)이다. ▶BIP 연구: 베자피브레이트를 사용해 심혈관질환 합병증(관상동맥질환 사망 및 비치명적 심근경색) 감소율에 대한 효과를 살펴본 연구로서, 전체 환자에서 유의한 효과가 없었으나, 중성지방이 200 mg/dL 이상인 환자군에서는 1차 종말점이 40% 감소하였다. ▶FIELD 연구: 페노피브레이트를 사용해 당뇨병 환자에서 심혈관질환 합병증 발생률을 감소시킬 수 있는지 알아본 연구이다. |
중성지방뿐만 아니라 HDL-C을 높이는 페노피브레이트
페노피브레이트는 현재 중성지방 강하효과가 뛰어난 약제로 알려져 있으나, 살펴본 연구들에서는 HDL-C이 낮은 환자에서 HDL-C을 증가시킴으로써 효용성을 입증했다.
VA-HIT 연구에서 HDL-C≤ 40 mg/dL, 중성지방 수치는 정상인 환자들을 대상으로 해 연구를 진행한 결과 HDL-C은 6% 증가하고, 중성지방은 31% 감소했다. 1차 종말점인 관상동맥심질환 합병증은 22% 감소했고, 2차 종말점인 관상동맥심질환으로 인한 사망, 비치명적인 심근경색, 뇌졸중 등은 30% 감소되는 효과가 보고됐다.
베자피브레이트를 사용한 BIP 연구에는 HDL-C≤35 mg/dL인 환자들을 대상으로 이차예방 연구를 진행했는데, 대사증후군(높은 중성지방, 낮은 HDL-C) 환자군에서 베자피브레이트의 유용성이 증명됐다.
FIELD 연구 고찰
위에서 살펴본 연구들 중 FIELD 연구를 보다 세부적으로 살펴보고자 한다.
1. 환자 특성 및 연구 디자인
FIELD 연구는 50∼75세인 제2형 당뇨병 환자 9795명을 대상으로 페노피브레이트 1일 200 mg 투약군(4895명)과 위약군(4900명)으로 무작위 배정하여 5년간 관찰했다. 종말점은 다음과 같다.
▶1차 종말점: 관상동맥심질환 합병증(관상동맥질환 사망+비치명적 심근경색)
▶2차 종말점: 주요 관상동맥질환 합병증(심혈관질환/비치명적 심근경색/비치명적 뇌졸중) 발생률, 총 관상동맥질환 합병증 발생률, 관상동맥심질환 사망, 총 관상동맥질환 사망
▶3차 종말점: 신장질환의 진행, 망막병증 치료, 비치명적인 암, 절단수술률 흥미로운 점은 FIELD 연구에 포함된 환자들 중 이상지질혈증 환자는 37%로, 이상지질혈증 환자들을 대상으로 진행된 연구라기보다는 당뇨병을 동반한 환자를 대상으로 페노피브레이트의 효용성을 살펴본 연구로 볼 수 있다는 점이다.
2. 연구 결과
4개월 후 HDL-C이 5% 증가했으나, 연구가 종료될 시점에는 1.2%로 감소돼 별다른 차이를 나타내지 않았다. 뿐만 아니라, 중성지방은 20% 이상 감소했으나, 이러한 차이에도 불구하고 페노피브레이트를 추가한 군과 그렇지 않은 군 사이에 1차 종말점에서 11% 감소 효과가 보고되었으나 유의하지 않았고(p=0.16), 2차 종말점도 총 11% 감소했다(p=0.035).
FIELD 연구의 가장 큰 문제점은 연구 도중 페노피브레이트 투약군에서는 8%, 위약군에서 약 20%의 환자가 스타틴을 복용하게 되었고(drop-ins), 이러한 스타틴 효과를 보정했을 때, 1차 종말점은 19% (p=0.01), 2차 종말점은 15% (p=0.004) 제한적으로 감소하는 결과가 보고됐다는 점이다.
또한 스타틴 효과를 보정했을 때, 페노피브레이트 투약군에서 HDL-C이 위약군에 비해 2.1% 밖에 증가하지 않았다.
흥미로운 점은 심혈관질환 합병증을 겪지 않은 환자군에서 합병증을 겪은 환자군보다 유의한 감소 효과가 보고됐다는 점이다. 이전에 심혈관질환 합병증을 겪지 않은 환자에서 1차 종말점인 관상동맥심질환 합병증은 25%(p=0.014), 2차 종말점인 총 관상동맥질환 합병증은 15%(p=0.004) 유의하게 감소했다.
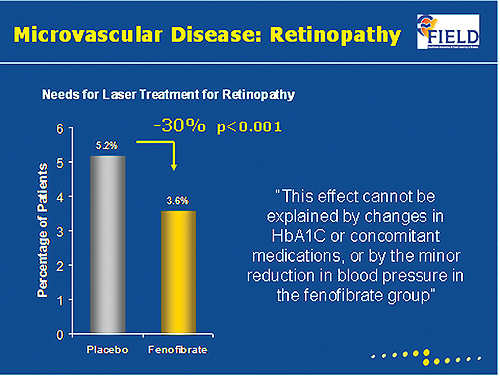
한편, PPAR-α (peroxisome proliferator activated receptor alpha)을 강화시키는 페노피브레이트의 효과로 미세혈관질환인 망막병증은 페노피브레이트 투약군에서 위약군 대비 30% 감소했고(P<0.001)<그림 1>,
3. 결론
FIELD 연구는 9795명을 대상으로 한 대규모 연구로서 이상지질혈증 유무와 관계없이 전체적으로 좋은 혈당 조절 효과를 나타냈다. 1차 종말점에서 11% 감소 효과가 보고됐으나, 유의하지 않았다(p=0.16).
뿐만 아니라 위약군에서 스타틴을 복용하는 비율이 높아 보정을 했는데, 보정 시 1차 종말점인 관상동맥심질환 합병증은 제한적으로 19% 감소했고, 2차 종말점인 총 관상동맥질환 합병증도 15% 정도 제한적으로 감소했다.
한편, 심혈관질환 합병증을 겪지 않은 환자에서 겪은 환자보다 유의하게 심혈관질환 합병증이 감소돼 1차 종말점인 관상동맥심질환 합병증은 25%(p=0.014), 2차 종말점인 총 관상동맥질환 합병증은 15%(p=0.004) 유의하게 감소했다.
긍정적인 점으로는 알부민뇨의 진행 및 망막병증의 진행 등의 미세혈관질환은 페노피브레이트가 유의하게 개선 효과를 보였다는 점이다.
ACCORD 연구 고찰
ACCORD 연구는 하나의 연구에서 혈당·혈압·지질에 대한 효과를 모두 살펴본 연구이다.
1. 환자 특성 및 연구 디자인
ACCORD Lipid 연구의 대상 환자는 심혈관질환 고위험을 동반하면서 제2형 당뇨병인 환자들이 포함됐는데, 환자들의 2/3 는 중성지방의 중간값이 162 mg/dL(1.83 mmol/L)으로 현행 지침에서 피브레이트 요법 등의 추가적인 요법을 권고하는 200 mg/dL(2.3 mmol/L) 이상이 아닌 환자들로 구성됐다. 즉 1/3만이 중성지방 수치가 높다는 점은 FIELD 연구와 유사하다.
5518명의 환자들은 심바스타틴+페노피브레이트 투약군(n=2765) 또는 심바스타틴+위약군(n=2753)으로 분류돼 무작위 배정됐다. 제2형 당뇨병 환자들의 당화혈색소를 6.0% 이하로 엄격하게 유지하는 군과 통상적인 수준(7.0-7.9%)으로 유지하는 군으로 나누어 비교했다.
즉, 양 군 모두 스타틴을 복용하고 있었으므로, 추가적으로 페노피브레이트를 복용하는 것이 추가적인 이점이 있는지에 대해 살펴본 연구이다. 스타틴으로 LDL-C은 어느 정도 조절되고 중성지방은 200 mg/dL 미만의 환자를 대상으로 했기에 이 연구에서도 HDL-C의 효과에 초점이 맞춰져 있다는 것을 주목할 필요가 있다. 대상 환자들의 평균 LDL-C은 100 mg/dL, 평균 HDL-C≤ 40 mg/dL, 평균 중성지방 162 mg/dL이었다.
▶ 1차 종말점: 심혈관질환 합병증의 발생(심혈관질환 사망, 비치명적 심근경색, 비치명적 뇌졸중)의 발생
▶ 2차 종말점: 대혈관질환, 입원율, 심부전
2. 연구 결과
LDL-C은 심바스타틴+페노피브레이트 투약군 또는 심바스타틴+페노피브레이트 투약군 모두 100 mg/dL에서 80 mg/dL으로 감소했으며(p=0.16), HDL-C은 심바스타틴+페노피브레이트 투약군 41.2 mg/dL, 심바스타틴+위약군 40.5 mg/dL으로 유사한 증가 효과를 보였는데 페노피브레이트로 인한 효과가 1 mg/dL도 나지 않았다는 점은 아쉬운 점이다(p=0.01).
중성지방은 각각 심바스타틴+페노피브레이트 투약군 147 mg/dL, 심바스타틴+페노피브레이트 투약군 170 mg/dL로 피브레이트의 개선 효과가 증명됐으나, 중성지방의 감소 효과는 연구에서 큰 의미를 나타내지는 못했다.
치료 후 적극적인 치료군의 당화혈색소는 6.5%로 통상 치료군(7.5%)보다 훨씬 낮음에도 불구하고, 1차 종말점(심근경색증·뇌졸중·심혈관질환 사망률)은 양군간 유의한 차이가 없었다(6.9% vs 7.2%). 2차 종말점은 적극적인 치료군에서 유익한 효과가 보고됐으나 유의한 의미를 나타내지는 못하고 있다.
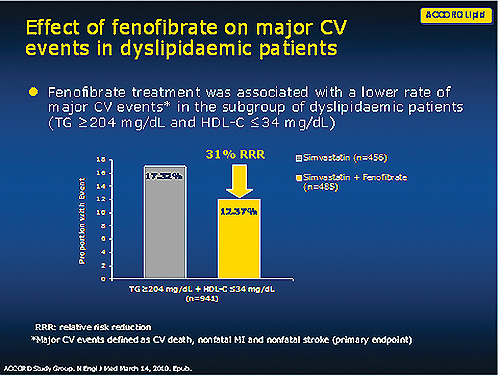
그렇지만, 중성지방이204 mg/dL 이상이고 HDL-C 34 mg/dL 이하인 환자군을 대상으로 한 하위분석에서 페노피브레이트의 뛰어난 주요 심혈관질환 합병증 감소 효과가 보고됐다<그림 2>.
안전성 측면에서는 별다른 부작용이 보고되지 않았다.
3. 결론
피브레이트는 심혈관질환 고위험을 동반한 당뇨병 환자에게 전반적으로 투여될 수는 없지만, 기존의 연구 및 ACCORD 연구결과와 같이 고위험도를 가지는 당뇨병 환자에게 스타틴은 우선적으로 투여될 수 있다.
또한 스타틴으로도 이상지질혈증이 조절되지 않는 대상자에게 페노피브레이트 병용요법을 고려하여야 하며, 중성지방의 상승 및 HDL-C의 하강을 보이는 대사증후군 환자에게 피브레이트의 병용요법을 시도할 수 있다. 이러한 환자들은 잔존하는 위험(residual risk)을 동반하기 때문이다.
아쉽게도 본 연구결과에서 의도한 HDL-C의 교정 효과는 결과적으로 기대할 수 없었다.
죽상경화성 이상지질혈증의 치료에서 지질 조절을 위한 피브레이트 병용의 역할
The role of fibrate in Combination Lipid-modifying Therapy(Athergenic Dyslipidemia)

NCEP-ATPⅢ 가이드라인에서는 심혈관질환 위험도와 LDL-C을 기준으로 이상지질혈증의 치료 원칙을 다음과 같이 제시하고 있다.
|
▶ 10년간 심혈관질환 발생위험이 20% 이상인 고위험군: <100 mg/dL (초고위험군의 경우 <70 mg/dL), ▶ 심혈관질환 발생 위험요인을 2가지 이상 가지고 있고 10년간 심혈관질환 발생위험이 10~20% 사이인 중등도 위험군: <130 mg/dL, ▶ 1개 이하의 심혈관질환 발생 위험인자를 가진 저위험군: <160 mg/dL *심혈관질환 발생 위험요인: 말초동맥질환(peripheral arterial disease)·경동맥질환(carotid artery disease)·복부 대동맥류(abdominal aortic disease)·당뇨병 |
그러나 최근에는 이러한 LDL-C의 조절만으로는 이상지질혈증을 치료하기에 부족하다는 의견이 대두되고 있어 이를 위한 약제들을 소개하고자 한다.
▶스타틴 : LDL-C을 낮추는 효과가 강하고 중성지방을 약하게 감소시킨다.
▶피브레이트 : 중성지방을 감소시키는 효과가 높으며 LDL-C을 낮추는 효과는 약하다.
▶나이아신 : LDL-C을 낮추는 효과가 강하고 그 외 중성지방을 낮추거나 HDL-C을 높이는 효과가 있다.
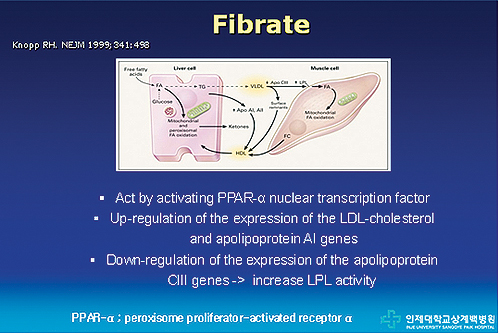
피브레이트의 작용기전
피브레이트는 PPAR-α agonist로, 간에서 중성지방 합성을 억제하고, 중성지방의 산화를 촉진시킴으로써 중성지방의 생성을 억제한다.
또한, LPL을 억제하는 apo C-III의 합성을 감소시켜, 결과적으로 VLDL의 전송 속도(transfer rate)를 높여 중성지방의 잔류를 감소시키고, HDL의 중요한 구성요소인 Apo A-I, II의 합성을 증가시켜 HDL-C 농도를 증가시킨다<그림 1>.
ACCORD Lipid 연구 요약
ACCORD Lipid 연구는 심바스타틴을 투여하고 있었던 환자들에게 페노피브레이트 및 위약을 투여한 효과를 관찰한 연구이다.
연구 결과 LDL-C은 양군간 차이가 없었고, HDL-C과 중성지방은 차이가 있었으나, 관상동맥심질환 합병증(관상동맥질환 사망+비치명적 심근경색)을 살펴본 1차 종말점은 양군간 유의한 차이가 없었다.
위험도가 낮은 여성에서는 페노피브레이트를 추가한 효과가 없어 보이는 측면이 있었다. 모든 환자에서 위험도 감소가 10.1%(harazd ratio)로 양 군간 차이가 없었다.
반면, 중성지방이 200 mg/dL 이상이면서 HDL이 34 mg/dL인 고위험군 환자를 하위 분석했을 때 심바스타틴+페노피브레이트 투약군 12.4% vs. 심바스타틴+위약군 17.3%로 페노피브레이트를 추가했을 때 유의한 위험 감소를 나타냈다.
안전성 측면에서는 크레아티닌이 10배 이상 상승한 심각한 부작용 발생 증례의 경우 양군간 차이가 없었다(심바스타틴+페노피브레이트 투약군 0.4% vs. 심바스타틴+위약군 0.3%). ALT가 3배 이상 상승한 부작용 발생 증례의 경우에도 양군간 차이가 없었다(심바스타틴+페노피브레이트 투약군 1.9% vs. 심바스타틴+위약군 1.5%).
그러나 미세알부민뇨증과 망막병증의 경우 페노피브레이트를 투여한 군에서 유의하게 감소하는 효과를 나타냈다.
이러한 ACCORD Lipid 연구의 결과를 토대로 중성지방이 높고 HDL이 낮은 고위험군 환자의 경우 다양한 가이드라인에서 피브레이트를 권고하고 있다.
중성지방 조절의 필요성
2008년에는 고용량 스타틴 약물로 LDL-C 수치를 70 mg/dL로 감소시켰음에도, 중성지방이 200 mg/dL 이상인 환자들의 경우 중성지방이 200 mg/dL 미만인 환자들에 비해서 사망, 심근경색, 급성관상동맥증후군의 위험성이 56% 증가한 결과가 보고됐다(Miller M et al., J Am Coll Cardiol. 2008:19;51(7):724-30).
아토르바스타틴+페노피브레이트 병용요법과 아토르바스타틴 단일요법, 페노피브레이트 단일요법의 지질 수치 변화를 살펴보았다. 이 때 페노피브레이트는 미세화된 페노피브레이트를 사용했다.
그 결과, 단일요법에 비해 병용요법에서 지질 수치 변화량이 탁월하게 개선된 것으로 보고됐다(Athyros VG et al. Diabetes Care. 2002;25(7):1198-1202)<그림 2>.
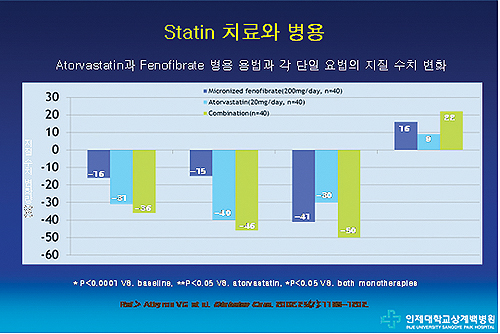
세부적으로는 LDL-C 수치 도달률은 병용요법군에서 가장 우수했다(페노피브레이트 단일요법 5%, 아토르바스타틴 단일요법 80%, 아토르바스타틴+페노피브레이트 97.5%).
중성지방 수치의 목표 수치 도달률도 병용요법군에서 탁월한 효과를 입증했다(페노피브레이트 단일요법군 92.5%, 아토르바스타틴 단일요법군 79%, 아토르바스타틴+페노피브레이트 병용요법군 100%). 이러한 경향은 HDL-C에서도 이어져 역시 병용요법군에서 효과가 가장 우월했다(페노피브레이트 단일요법군 30%, 아토르바스타틴 단일요법군 17.5%, 아토르바스타틴+페노피브레이트 병용요법군 60%).
안전성 측면에서는 10년 이내 심근경색 발생 가능성을 살펴보았는데, 기저선 21.6%, 페노피브레이트 투약군 10.9% 아토바스타틴 투약군 7.5% 병용요법군 4.2%로 병용요법군에서 안전성이 가장 뛰어났다.
페노피브레이트의 특성 및 역사
페노피브레이트는 중성지방의 치료에 유용한 약제로 널리 알려져있다. 현재 출시된 페노피브레이트는 미세입자(micronized particle)로 용해성과 흡수율이 뛰어나 생체이용율이 우수한 특징을 갖고 있다.
패 널 토 의
김효수: 김상현 교수님께서 강연에서 중성지방도 위험인자임을 설명하셨습니다. 한기훈 교수님께서는 중성지방을 낮춘 효과를 살펴본 임상연구들을 검토하셨는데, 1차 종말점을 만족시킨 연구도 있었고, 그렇지 않은 연구도 있었습니다. 하위분석에서는 일관성 있게 효과가 있었습니다.
결국, 스타틴을 기본으로 하여 페노피브레이트를 병용했을 때 이점을 설명하셨습니다.
박병은: 김병옥 교수님, 중성지방 수치의 차이에 의해서 사망·심근경색·급성관상동맥증후군의 위험성이 56% 증가했다고 설명하셨는데, 중성지방 조절로 얻는 이점으로 매우 탁월한 측면이 있는 것 같습니다.
환자들이 이미 LDL-C 수치를 70 mg/dL로 조절된 상태로 위험이 감소한 상태에서 중성지방 수치의 차이로 인해 큰 차이가 발생했다는 점이 흥미롭습니다. 그렇다면 LDL-C가 조절되어 위험이 감소한 환자군에서 추가적인 위험 감소가 크다는 의미로 해석할 수 있습니까?
한기훈: PROVE IT 연구의 추후 연구 결과인데, 피브레이트나 중성지방 조절을 하지 않은 환자를 다시 분석했다는 점을 유념하실 필요가 있습니다. 이러한 상황에서 LDL-C을 70 mg/dL 미만으로 낮춘 환자에서 중성지방이 높은 경우 상대적으로 위험이 더 높다는 관찰결과입니다.
여기서 56% 증가는 보정되지 않은 수치로, 다른 환경적인 요인들로 인해 중성지방이 높아진 것을 전부 통합한 결과입니다. 이를 보정했을 경우 위험비(hazard ratio)가 0.76으로 중성지방만 높았을 경우 위험이 20% 정도 증가한다고 생각하시면 될 것 같습니다. LDL-C이 낮은 상황에서 중성지방이 높았을 때 위험이 더 증가한다는 의미는 아닙니다.
김효수: 중성지방의 위험성에 대해서는 이견이 많습니다. 어떤 연구에서는 중성지방이 위험을 예측한다고 하고 어떤 연구에서는 예측하지 못한다는 이야기가 많습니다.
분명한 컨센서스는 중성지방이 높은데 HDL-C이 낮으면 중성지방이 예후에 관한 분명한 예측인자로서 가치를 갖는다는 점입니다. 이는 small dense LDL이나 ApoB가 개재하기 때문이라고 생각합니다.
조상호: LDL-C을 70 mg/dL 미만이어도 중성지방을 낮추면 더 좋을 것인가는 의문점이고, 스타틴을 고용량으로 처방하거나 좀더 강력한 스타틴을 사용하는 최근의 현 상황에서 페노피브레이트가 이점이 있을까요? 죽상경화증이 많이 진행되지 않은 상태이거나, 당뇨병을 동반한 환자가 중성지방이 높은데 HDL-C마저 감소된 경우에 페노피브레이트가 효과적이라고 생각합니다.
김효수: ACCORD Lipid 연구에서는 심바스타틴 20∼40 mg을 투여하고 페노피브레이트를 추가할 것인지 아닌지를 비교했습니다.
페노피브레이트가 효과적이라고 생각한 대상 환자는 당뇨병 환자였고, 전체적으로는 긍정적인 결과를 도출하지 못했지만, [1] 당뇨병이면서 [2] 중성지방 200 mg/dL 이상 [3] HDL이 35 mg/dL 미만인 환자군에서는 확실하게 유익했던 것을 보면, 이러한 특정군에서는 반드시 페노피브레이트를 추가해야 한다고 생각합니다.
고용량 스타틴을 사용한다고 해도 대사증후군 환자의 경우는 중성지방을 낮추는 효과가 있기는 하지만 미약합니다. 그리고 스타틴을 가지고 중성지방을 낮추어서 임상결과를 호전시킨다는 근거는 아직 없습니다.
한기훈: ACCORD Lipid 연구의 하위군 분석에서 LDL-C의 수치에 따른 이점이 제시돼 있습니다. ACCORD Lipid 연구에서 LDL-C을 80 mg/dL으로 낮춘 군이라도 당뇨병을 동반한 환자에서는 추가적으로 이익이 있었던 것은 사실입니다.
FILED 연구에서는 2차 예방에서는 효과가 없는 것처럼 나오지만 이는 조금 과장된 측면이 있습니다. 왜냐하면 FILED 연구에서 심혈관질환을 동반한 환자가 1/3밖에 안됐기 때문에 이를 하위분석을 하면 당연히 통계력이 떨어집니다.
피브레이트가 심혈관질환을 동반한 환자를 악화시킨다는 의견까지 제시됐는데 그렇게까지 볼 필요는 없을 것 같습니다.
김효수: FILED 연구는 drop-in과 drop-out이 너무 심했던 연구여서 별로 인용하고 싶은 연구는 아닙니다만, FILED 연구에서조차도 중성지방이 높은데 HDL-C 낮은 환자의 경우 페노피브레이트가 유익하다는 것을 증명했습니다.
ACCORD Lipid나 FILED 연구에서 페노피브레이트가 미세혈관질환을 감소시키는데, 반면 스타틴 연구에서는 이러한 효과가 보고된 경우가 별로 없는 것 같습니다. 스타틴과 페노피브레이트가 기전상 다르기 때문일까요? 페노피브레이트가 어떻게 미세혈관질환을 감소시키는 것일까요?
박병은: 페노피브레이트가 미세혈관질환을 감소시키는 결과가 실제 중성지방 수치와는 무관하기 때문에 작용기전 자체는 중성지방 이외의 효과라고 생각합니다.
김효수: PPAR-α는 여러 기관에 작용하니까요. 미세혈관질환도 다양합니다. 미세알부민뇨증·망막병증 등 다양합니다만, 결국 최종당화산물(glycation end-product)이 영향을 미칠 지, 과다한 산화스트레스가 작용을 할 지 모르겠는데, PPAR-α agonist인 피브레이트가 이러한 측면에서 스타틴보다 좀더 유익한 작용을 하는 것 같습니다. 혹시 이에 대한 근거 자료를 아십니까?
한기훈: 페노피브레이트가 피브레이트 중에서 PPAR-α 강화 효과가 상대적으로 강합니다. 김효수 교수님께서 지적하신 것처럼 페노피브레이트의 PPAR-α의 강화 효과로 직·간접적으로 미세혈관질환을 억제한다고 보는 것이 타당한 것 같습니다.
또한 인슐린 저항성을 감소시키는 효과가 말초혈관질환을 감소시키는 가장 중요한 기전이기 때문에 부분적으로 인슐린 저항성을 호전시킴으로써 당뇨병 환자에게 다양한 부가적인 효과가 있을 것이라고 생각합니다.
김효수: PPAR-α agonist가 인슐린 저항성을 개선시켜주는 자료가 있나요?
한기훈: 약리적인 작용자체가 1차 타깃이 지방세포(adipocyte)인데, 거기에서 인슐린의 활성이나 감수성을 올리는 것이 페노피브레이트의 1차적인 약리작용입니다.
김효수: 그렇다면 피브레이트가 미세혈관질환을 줄이는 근거로서 인슐린 저항성 개선 기전을 들 수 있을 것 같습니다.
마지막으로 ACCORD Lipid 연구에서 중성지방이 높고 HDL-C이 낮은 당뇨병 환자에게 스타틴을 투여한 후 페노피브레이트를 추가하는 것이 유익할 것이라고 나왔는데, 스타틴도 근육병증·간효소 수치를 증가시키는데 페노피브레이트를 추가하면 위험이 더 증가할 것이라고 생각하는 의견이 있었습니다.
따라서 페노피브레이트가 횡문근 용해증이나 간효소의 수치에 악영향을 미칠까 우려를 했던 것이 사실입니다. 선생님들께서는 병용요법에 대해서 어떻게 생각하십니까?
한기훈: 저는 병용요법을 자주 시행하는 편입니다. 제가 진료를 하는 환자의 특성이 대사증후군이나 당뇨병을 동반하는 경우가 많은 반면, 시술을 한 환자는 상대적으로 적은 편입니다.
요새 부가적으로 간 독성에 대한 언급이 많은데요, 지방간 호전을 유도하는 중요한 두 가지 약제 중 하나가 피브레이트입니다. 내분비쪽에서는 피브레이트에 메트포르민을 병용했을 때 지방간도 호전된다는 근거가 많이 도출된 바 있습니다.
김병옥: 예전에 겜피브로질과 세리바스타틴을 병용했을 때 부작용이 발생된 바 있는데, 최근에 문제가 보고된 경우는 없었던 것 같습니다. 오히려 한기훈 교수님처럼 스타틴을 장기간 사용해 인슐린 저항성이 증가됐을 때 피브레이트를 병용하면 인슐린 저항성을 감소시킬 수 있을 것 같아서 복합제제가 출시될 것 같습니다.
김효수: 스타틴과 피브레이트의 복합제제가 거론될 정도로 두 약제 병용의 안전성에 대한 확신이 증대된 것 같습니다. 저도 병용요법을 많이 시행합니다만, 이상반응이 나탄 난 환자를 별로 기억하지 못할 정도로 안전한 것 같습니다.
김병옥: 고위험군·고령·신기능이 감소된 말기 신부전 환자에게 고용량 스타틴과 병용하는 것은 위험합니다. 고용량 스타틴 자체가 크레아티닌을 상승시키고 근육병증의 우려가 제기되고 있기 때문입니다.
김병옥: 근거가 많지 않지만 2차 예방에서도 병용요법이 필요할 것 같습니다. 당뇨병 환자의 병용요법은 권고되지만, 당뇨병이 없는 환자의 2차 예방에 대한 연구가 있어야 할 것 같습니다.
김효수: 결론적으로 중성지방이 예측인자로 작용하는 것에는 논란이 있지만, 높은 중성지방과 낮은 HDL-C가 만나면 분명한 예측인자로 작용한다는 점입니다.
따라서 치료할 필요가 있는데 ACCORD Lipid 연구에서 스타틴과 페노피브레이트를 투여했을 때 효과가 있는 환자 군은 높은 중성지방과 낮은 HDL-C을 보이는 당뇨병 환자였습니다. 가이드라인에서도 LDL-C을 조절하고 중성지방을 조절하라고 되어 있기에 이러한 환자들에게는 안전성을 우려하기보다는 적극적으로 병용하는 것이 좋다고 생각합니다.


