' 당뇨병 치료 및 진단의 최신지견 '
대한당뇨병학회와 의협신문이 주최하고 대웅제약이 후원하는 "대한당뇨병학회 지상좌담회"가 앞으로 3회에 걸쳐 기획 연재된다.
1편으로 "Substantial and Durable glycemic control ; Incretin-based therapy"를 주제로 고려의대 최동섭 교수, 가톨릭의대 김성래 교수, 성균관의대 이원영 교수, 고려의대 김신곤 교수. 서울의대 문민경 교수, 중문의대 김수경 교수가 최근 많은 관심을 끌고 있는 신개념의 당뇨병 치료제인 인크레틴에 관련된 최신 연구결과 및 최신 지견에 대한 review를 게재하였다. <편집자 주>

새로운 당뇨병 약제의 필요성

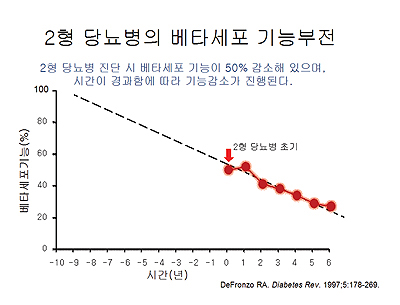
이 유행처럼 번져가는 질환은 안타깝게도 현재까지는 '진행하는' 질환이다. 제2형 당뇨병은 처음 진단 시에 이미 췌장 베타세포의 인슐린 분비능이 50% 감소되어 있고 시간이 지남에 따라 베타세포의 인슐린 분비능은 점진적으로 감소한다.
따라서 당뇨병의 유병기간이 길어지면 사용하고 있는 약제의 혈당강하 작용이 감소되면서 점차 혈당이 상승하게 된다.
최근까지 이런 당뇨병의 병태생리를 전환시킬 수 있는 약제는 없었으며 장기간의 추적 관찰연구에서 현재 사용되고 있는 약제들은 목표혈당을 유지하는데 그다지 성공적이지 못했다.
최근에 사용되기 시작한 인크레틴에 근거한 치료제인 GLP-1 작용제 및 DPP-4 억제제는 기존의 약제와는 달리 동물 실험에서 많은 용량을 투여하면 베타세포의 증식과 분화를 증가시킨다고 보고되어 있으나 권장 용량으로 장기간 사용시 사람에서도 베타세포 기능을 보존할 수 있는지는 앞으로 밝혀야 할 과제이다.
췌장 베타세포 기능 부전이 주요 기전인 우리나라 제2형 당뇨병 환자에서 GLP-1 작용제 및 DPP-4 억제제는 치료약제로서 기대되는 바가 크나, 초기 치료제로서 또는 기존의 약제와의 병합요법으로 장기간 지속적인 혈당조절 효과를 가져올 수 있는지는 향후 연구를 통해 규명되어야 한다.
장기간 성공적인 혈당조절을 위해서는 베타세포 기능 보존이 필요하며 최근 당뇨병 치료 지침 및 약제 개발도 여기에 초점이 맞추어져 있다. 제2형 당뇨병에서 베타세포 기능부전의 기전은 명확하게 밝혀져 있지 않으나 당지질 독성 등 여러 기전이 관여할 것으로 생각되고 있다.
최근에는 비만과 이에 의한 골격근내의 지방산중간물질 축적에 의한 염증반응이 인슐린 저항성 및 베타세포 파괴에도 관여한다는 연구들이 발표되고 있다.
따라서 초기에 베타세포 기능을 보존할 수 있는 약제와 함께 당뇨병 치료제로서 염증경로를 조정할 수 있는 새로운 약제의 개발과 임상연구도 필요하다고 생각된다.
제2형 당뇨병에서 인슐린 분비장애는 확실한 사실이지만 이러한 결함이 췌도 베타세포의 양 (beta cell mass)의 감소에 의한 것인지, 숫자는 정상이나 세포의 기능장애에 의한 것인지 혹은 세포의 감소와 기능의 장애를 동반하는 것인지는 아직까지 불명확하다.
그리고 글루카곤 분비의 정상적인 조절과정이 아직 확실히 알려져 있지 않으므로 알파세포의 결함에 미치는 베타 세포 기능이상의 영향에 대해서도 잘 알려져 있지 않다.
Beta cell preservation in the pathopathysiology of type 2 diabetes

또한 이러한 췌도세포의 크기 감소는 주로 베타세포의 감소에 기인하며 그 밖의 구성세포 즉 알파, 델타, 폴리펩타이드 세포에는 큰 변화가 없는 것으로 밝혀져 있다(그림1).
연구에 의하면 제2형 당뇨병환자는 진단 당시 이미 베타세포 기능이 50% 감소되어있고 시간의 경과에 따라 기능감소가 진행하는 것으로 알려져 있다.
따라서 지속적인 혈당 조절을 위해서는 베타세포 기능의 유지가 필요하고, 이러한 내용은 ADOPT 연구에서도 베타세포의 기능을 유지시켜주는 것으로 알려진 Rosiglitazone이 비교 대상이었던 설폰요소제나 메트포르민보다 더 오랬동안 혈당조절이 잘 되었던 결과에서도 확인되었다.
최근 임상에서 사용되기 시작한 DPP-IV inhibitor의 경우에도 베타세포 기능을 유지시켜줄 수 있다는 임상연구 결과들이 있어서, 효과적인 혈당조절뿐 아니라 지속적인 혈당조절을 위해서도 그 역할이 기대가 된다.
인크레틴 생리 (Incretin Physiology)

1932 년 La Barre는 상부장관의 점막 추출물질이 혈당을 떨어뜨리는 작용이 있다고 하였다. 그는 최초로 이 물질을 incretin이라고 명명하였고 언젠가는 사람의 당뇨병 치료에 incretin이 이용될 것이라고 예견하였다.
같은 혈당수치를 유지하는 조건을 만들었을 때, 포도당 정맥주사한 경우보다, 포도당 경구투여한 경우에서 혈중 인슐린 농도가 훨씬 높게 증가하는 현상을 인크레틴 효과라고 한다(1, 2, 그림 2).

즉 인크레틴이란 음식 섭취 후, 위장관에서 분비되어, 췌장에서 포도당 자극에 의한 인슐린 분비 (glucose-stimulated insulin secretion, GSIS)를 촉진하는 호르몬들을 뜻한다. 경구 포도당 투여 후 분비되는 전체 인슐린의 약 50-70%는 인크레틴 효과에 의한다고 알려져 있다.
처음 발견된 인크레틴 호르몬은 GIP로서 동물에서 위산 분비를 억제하는 작용이 관찰되어 gastric inhibitory polypeptide (GIP)로 초기에 명명되었다(3).
그 후 정제된 GIP를 이용한 실험을 통하여 인슐린 분비를 촉진하는 생리적 효과가 있음이 밝혀져 glucose-dependent insulinotropic polypeptide (GIP)로 불리게 되었다. GIP는 포도당이나 지방을 섭취한 후 소장의 K 세포에서 분비된다. 그러나 GIP가 인크레틴 효과의 전부를 담당하는 것은 아니다.
더 중요한 인크레틴 호르몬은 두 번째로 발견된 GLP-1 (glucagon like peptide-1)로서 프로글루카곤 유전자로부터 합성된다.
현재까지 사람에서 인크레틴 호르몬의 정의에 부합하는 것은 GIP와 GLP-1 뿐이며 이들은 포도당 자극에 의한 인슐린 분비를 서로 부가적인 방식으로 강화시킨다. 본 란에서는 GIP와 GLP-1의 생리적 작용에 대해 간략히 서술하고자 한다.
GIP (Glucose-dependent insulinotropic polypeptide)
GIP는 처음 규명된 인크레틴 호르몬으로서, 상부 소장의 K 세포에서 분비된다. GIP 수용체는 췌도세포, 지방조직, 심장, 뇌하수체, 부신수질, 뇌의 여러 부위에 존재하며, 각 조직에서의 기능은 연구되고 있다.
사람에서 공복시 GIP 혈중 농도는 0.06-0.1 nmol/L 이며 (전체 GIP, 활성 GIP에 따라), 식후에는 0.2-0.5 nmol/L까지 증가한다. GIP가 췌도베타세포에 있는 GIP 수용체와 결합하면 인슐린 분비를 자극하게 된다.
GLP-1은 췌도 알파세포에 작용해서 글루카곤 분비를 억제하지만, 반대로 GIP는 글루카곤 분비를 경미하게 자극한다고 알려져 있다. GIP는 포도당 의존적인 인슐린 분비를 자극하고 베타세포의 증식, 세포사멸 억제효과가 있지만, 위 배출 및 음식섭취에는 영향을 주지 못한다.
GLP-1 (glucagon like peptide-1)
GLP-1은 30개의 아미노산으로 구성되어 있으며 주로 원위부 회장과 대장에 분포된 L 세포에서 분비된다(4). GLP-1은 분비된 후 곧바로 DPP-4 (dipeptidyl peptidase-4)에 의해 불활성화되므로 혈중 반감기가 2 분 이내로 매우 짧다(5).
경구 탄수화물 섭취에 대한 인슐린 분비 반응의 상당부분이 GLP-1에 의해 매개되며, 췌도 베타세포에 있는 GLP-1 수용체에 결합하여 인슐린 분비를 자극한다.
또한 GLP-1은 인슐린 생합성의 전 과정을 자극하며 인슐린 유전자 전사를 촉진한다. 혈당이 정상이거나 낮은 경우에는 생리적으로 GLP-1에 의한 인슐린 분비가 촉진되지 않는다.
사람에서 공복 시 활성 GLP-1의 혈장 농도는 5-10 pmol/L이며 식후에는 약 2-3 배 증가한다 (6). 정상적으로 식후 증가하는 혈중 GLP-1 농도가 제2형 당뇨병 환자에서는 감소되어 있다 (6-8). 렙틴은 GLP-1 분비를 자극할 수 있음에도, 비만에서 GLP-1이 낮은 것은 렙틴 저항에 의한 것으로 추측된다 (9).
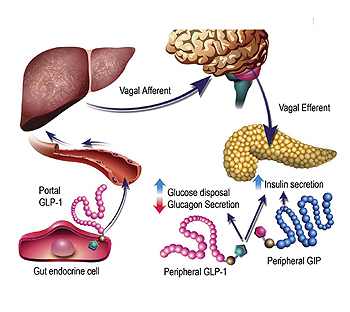
제2형 당뇨병에서 식후 GLP-1 분비가 감소되는 이유는 아직 밝혀져 있지 않다. GLP-1은 간문맥으로 분비되어 간문맥 포도당 센서를 활성화시키고 장벽, 문맥 내, 간 내의 미주신경 구심통로를 (afferent) 통해 중추신경계로 신호를 보낸다.
이후 미주신경 원심통로를 (efferent) 통해 인슐린분비를 자극한다. 이 과정이 GLP-1에 의해 인슐린 분비를 자극하는 가장 중요한 과정이 되겠다.
GLP-1은 췌도 알파세포에도 작용하여 식후 글루카곤 분비를 억제한다. 그러나 혈당이 65 mg/dL 미만 상태에서는 글루카곤 분비를 억제하지 않아, 저혈당에서 나타나는 길항작용은 보존시킨다. GLP-1은 또 다른 기전으로도 혈당강하 효과를 나타낸다.
음식물의 위 배출을 지연시키고 포만감을 자극하여 음식 섭취량을 줄이는 효과이며, 위 배출 지연은 vagovagal reflex를 매개한다고 알려져 있다. GLP-1은 췌도 베타세포 증식을 자극하고, 세포사멸을 억제한다고 보고되었다.
이상의 GLP-1 작용을 요약하면 다음과 같다.
(1) 포도당 의존적으로 인슐린 분비를 자극한다.
(2) 포도당 의존적으로 글루카곤 분비를 억제한다.
(3) 인슐린 생합성의 모든 단계를 자극하고 인슐린 유전자 발현을 증가시킨다.
또한 베타세포 기능에 필수적인 GLUT2, 글루코키네이즈 유전자 발현을 증가시킨다.
(4) 베타세포의 증식을 촉진하고 베타세포 사멸을 억제한다.
(5) 위 배출 속도를 지연시킨다.
(6) 포만감을 자극하여 음식 섭취량을 감소시킨다.
Dipeptidyl peptidase-4 (DPP-4)
GIP 및 GLP-1은 분비되거나 외부에서 투여된 경우, 곧바로 DPP-4 (dipeptidyl peptidase-4)에 의해 불활성화되므로 혈중 반감기가 2 분 이내로 매우 짧다. DPP-4는 원래, 림프구 표면 표지자 CD26으로도 알려진 효소로서, T 세포의 증식과 자극에도 관여한다.
DPP-4 단백은 거의 모든 기관에 분포하며 순환 효소로서의 역할 뿐 아니라 콜라겐, ADA (adenosine deaminase)와도 결합하고, 세포막과 결합되어 있는 형태로도 존재한다.
또한 장 혈관의 내피세포에도 광범위하게 분포되어 있어 문맥으로 들어가는 GLP-1의 반 이상은 이미 DPP-4에 의해 불활성화되어 있다(10).
GLP-1은 혈중의 DPP-4에 의해 바로 분해되어 약 2분 정도의 짧은 반감기를 가지므로, GLP-1 자체는 치료제로서 작용을 하지 못한다. Exenatide는 합성 GLP-1 유사체로서, DPP-4에 의해 인지되지 않아서 장기간 반감기를 가지므로 치료제로서 이용될 수 있다.
또한 DPP-4 억제제가, 내인성 GLP-1의 혈당강하 효과를 증가시키는 기전으로 새로이 개발되어 혈당강하제로서 널리 사용되고 있다.
결 론
GLP-1, GIP는 음식 섭취에 의존적으로 인슐린 분비를 자극하고 베타세포의 증식을 촉진하며 베타세포의 사멸억제 효과가 있다. GLP-1은 부수적인 효과로, 위 배출 속도를 늦추며 글루카곤 분비 억제, 식욕 억제 효과가 있다.
제2형 당뇨병 환자에서 인크레틴 효과는 상당히 감소되어 있는 바, 당뇨병 환자에서 GLP-1 혈중 농도를 높이면, 인슐린 분비 자극을 통하여 혈당을 효과적으로 낮출 수 있다(그림 3).
앞으로 인크레틴 작용을 통해 당뇨병의 병태 생리에 대한 이해를 넓히고 이를 바탕으로 개선된 당뇨병 치료법의 개발에 도움이 될 수 있을 것이다.
참고문헌
1.McIntyre N, HolsworthDC, TurnerDS. New interpretation of oral glucose tolerance. Lancet 2:20-21,1964
2. Girard J. The incretins: from the concept to their use in the treatment of type 2 diabetes. Part A; incretins: concept and physiologic functions. Diabetes Metab 34:550-559, 2008
3. Brown JC, Dryburgh JR, Ross SA, Dupre J. Identification and actions of gastric inhibitory polypeptide. Recent Prog Horm Res 31:487?532, 1975
4. Baggio LL, Drucker DJ. Biology of incretins: GLP-1 and GIP. Gastroenterology 132:2131-2157, 2007.
5. Deacon CF, Nauck MA, Toft-Nielsen M, Pridal L, Willms L, Holst JJ. Both subcutaneously and intravenously administered glucagon-like peptide 1 are rapidly degraded from the NH2-terminus in type II diabetic patients and in healthy subjects. Diabetes 44:1126?1131,1995
6. Vilsboll T, Krarup T, Deacon CF, Madsbad S, Holst JJ. Reduced postprandial concentrations of intact biologically active glucagon-like peptide 1 in type 2 diabetic patients. Diabetes 50:609?613,2001
7. Ranganath LR, Beety JM, Morgan LM, Wright JW, Howland R, Marks V. Attenuated GLP-1 secretion in obesity: cause or consequence? Gut 38:916?919,1996
8. Ranganath L, Norris F, Morgan L, Wright J, Marks V. Inhibition of carbohydrate-mediated glucagon-like peptide-1 (7-36)amide secretion by circulating non-esterified fatty acids. Clin Sci (Lond) 96:335?342,1999
9. Anini Y, Brubaker PL. Role of leptin in the regulation of glucagon-like peptide-1 secretion. Diabetes 52:252?259,2003
10. Hansen C, Deacon CF, Orskov C, Holst JJ. Glucagon-like peptide-1-(7-36)amide is transformed to glucagon-like peptide-1-(9-36)amide by dipeptidyl peptidase IV in the capillaries supplying the L cells of the porcine intestine. Endocrinology 140:5356?5363, 1999
11. Drucker DJ. The biology of incretin hormones. Cell Metab 3:153-65, 2006
GLP-1 agonists: a novel therapy to delay the progression of type 2 diabetes mellitus

따라서 적절한 치료에도 불구하고 투약하는 약제의 종류와 개수가 늘고, 상당수의 환자에서 인슐린 치료가 필요하게 된다. 만약 당뇨병의 자연경과 중에 나타나는 베타세포의 감소를 막거나 역전시킬 수 있는 약제가 있다면 상당히 이상적인 치료제가 될 수 있을 것이다.
현재까지 개발된 약제 중 글리타존(thiazolidinedione)과 GLP(glucagon like peptide)-1 agonist가 그 가능성을 보여주고 있다.
GLP-1은 회장(ileum) L-cell의 proglucagon gene으로부터 분비되는 peptide이다. 활성형 GLP-1의 반감기는 2분 미만으로 무척 짧은데, 이것은 GLP-1이 dipeptidyl peptidase-4 (DPP-4)에 의해서 분해되어 곧바로 비활성형으로 변환되기 때문이다. 따라서 DPP-4에 저항성이 있는 GLP-1 agonist가 개발되었다.
GLP-1 agonist의 대표적인 장점은 세 가지 정도로 요약된다. 첫째, 혈당 의존적으로 인슐린의 분비를 촉진한다. 즉 혈당의 농도가 높아지면 인슐린 분비를 자극하지만, 혈당이 낮아지면 인슐린 자극 능력이 감소한다.
이 점은 저혈당의 위험성을 피할 수 있다는 점에서 GLP-1 agonist의 중요한 장점이 된다. 둘째, 체중을 증가시키는 일반적인 혈당강하제와 달리, 6개월에 걸쳐 2-3kg 이상의 체중을 감량시킨다. GLP-1 agonist는 소화기관의 분비 및 운동을 억제시키는데, 특히 위배출을 지연하여 식후 고혈당의 상승을 억제한다.
이 외에도 뇌신경계에 작용하여 식욕을 떨어뜨리는 작용을 한다. 이런 GLP-1 agonist의 위배출 지연과 식욕감퇴 효과는 양날의 칼과 같아서 비만한 당뇨병 환자의 체중감량에 효과적인 치료제로 기능하는 반면 오심과 구토와 같은 약물 부작용의 원인이 되기도 한다.
마지막으로 GLP-1 agonist는 인슐린 유전자 뿐만 아니라 베타세포의 기능과 관련된 다양한 유전자의 표현을 증가시키고, 인슐린의 합성과 관련된 매 단계에 관여한다. 이 역시 인슐린의 분비만 촉진시킴으로 베타세포의 기능을 고갈시킬 가능성이 있는 설포요소제와 대별되는 GLP-1 agonist의 장점이라 할 수 있다.
실제 동물과 사람의 췌도세포를 이용한 실험에서 GLP-1 agonist가 췌장 베타세포의 기능을 좋게 할 가능성이 보고되었다. 베타세포의 양을 유지시키는 기전으로는 베타세포의 양을 늘리는 베타세포의 신생과 베타세포의 손실을 줄이는 베타세포의 자기사멸방지가 관여한다. GLP-1 agonist는 이 두 기전에 모두 작용하여 베타세포의 보호기능을 하는 것으로 알려지고 있다(그림 4).

그러나 동물이나 세포 수준에서의 긍정적인 실험결과가 실제 사람에서 재현될 지는 좀 더 지켜봐야 할 것이다.
어떤 신약도 장기적인 안전성 이슈로부터 자유롭지 못하다. GLP-1 agonist도 예외는 아니어서 췌장염의 유발과 같은 현재 제기된 이슈부터, 췌장베타세포 분화의 부정적 여파로 종양 증식이 유발될 가능성 등도 더 많은 임상경험을 통해 앞으로 확인되어야 한다.
또한 혈당강하효과가 당화혈색소 1% 이내로 기존 약제에 비해 강한 편이 아니며, 현재 사용가능한 exenatide의 경우 하루 두 번 맞는 주사제이고 고가라는 점도 처방할 때 고려되어야 할 점이다. 아직 시판되고 있지 않으나, 일일 1회 주사나 주 1회 주사제가 개발되어 임상시험 중에 있다.
이런 지속형 GLP-1 agonist는 기존 약제에 비해 위장장애 등 부작용은 적으면서, 혈당강하효과는 강한 것으로 보고되고 있어 향후 기대해볼만한 약물로 판단된다.
DPP-4 inhibitors: A new class of oral antihyper glycemic agent

GLP-1의 경우 N 말단부가 His7-Ala8로 되어 있어 GLP-1은 DPP-4에 의해 급속히 분해되어 비활성화된 형태가 된다.
제2형 당뇨병 환자에서 GLP-1분비가 감소해 있고, GLP-1의 치료로 혈당 조절이 개선됨이 알려졌으나, 체내에 분비되는 GLP-1은 몸 전체에 풍부히 존재하는 DPP-4에 의해 급격히 분해되어 반감기가 1-2분정도로 매우 짧다.
이에 인크레틴을 기반으로 하는 치료는 두 가지 방법으로 GLP-1의 농도를 증가시키려고 하고 있는데, 그 중 하나는 GLP-1 아나로그를 통해 DPP-4에 의해 분해되지 않도록 하는 것이고, 또 하나의 방법은 DPP-4 억제제를 이용해 혈중 GLP-1의 농도를 증가시키는 것이다(그림 5).

DPP-4 억제제는 주사제로 만들어진 GLP-1 아나로그와 달리 경구로 복용하며, 체중 유지 효과가 있고 저혈당이 거의 발생하지 않아 당뇨병의 최신 약제로 각광받고 있다. 국내에서는 작년 12월부터 보험 급여가 되기 시작하여 현재 sitagliptin (자누비아)와 vildagliptin (가브스)가 임상에서 쓰이고 있다.
Sitagliptin은 복용 후 급속히 흡수되어 1∼6 시간 후 혈중 최고농도에 도달하며 8∼14 시간의 반감기를 갖는다. 섭취된 약의 80%가 대사 없이 신장을 통해 배설되며 15%가 간에서 대사된다.
하루 100 mg의 sitagliptin을 복용하면 24시간동안 혈장 DPP4의 활성이 80% 이상 억제된다. 크레아티닌 청소율이 50 ml/min 미만으로 감소된 환자는 50 mg으로, 30 ml/min 미만으로 감소된 환자는 25 mg 으로 용량 감량이 필요하다.
제2형 당뇨병 환자를 대상으로 24주간 진행된 임상 연구에서 sitagliptin은 단독요법으로 0.6∼0.8%의 당화혈색소 감소 효과를 보였고, 메트폴민과의 병용 치료 시 당화혈색소 1.8%, 메트폴민 치료 중인 환자에서 sitagliptin을 추가한 경우에는 추가적으로 당화혈색소 0.7% 정도의 혈당 감소 효과를 보이는 것으로 나타났다.
현재 국내 보험 인정 기준으로는 메트폴민과의 병합 요법만 인정되고 있으나, 발표된 임상 연구에서는 pioglitazine 또는 glipizide와 병용 시에도 당화혈색소 0.6-0.7% 정도의 추가적인 혈당 강하 효과를 보였고, glimepiride와 메트폴민과의 삼제 병용 시에도 대조군과 비교하여 0.9% 정도의 혈당 강하 효과가 있었다. 여러 임상 연구에서 sitagliptin이 체중에 미치는 영향은 중립적이었고, 단독요법으로는 저혈당의 발생이 없었다. 비인두염, 접촉성 피부염, 골관절염, 요로감염, 두통 등의 부작용이 보고되었다(그림 5).
Vildagliptin은 복용 후 1∼2 시간에 혈중 최고 농도에 도달하며 혈중 반감기는 2시간으로 sitagliptin에 비해 짧다.
음식 섭취에 의해 약력학적 특성의 변화가 없고, 복용 후 45분 후에 DPP4의 활성이 98% 억제되며 24시간 후에는 60%가 억제된다. Vildagliptin의 85%가 간에서 가수분해에 의해 대사되고 나머지 15%는 신장에서 대사 없이 배설된다. 간기능에 따른 vildagliptin의 효과는 차이가 없는 것으로 보고되고 있다.
Vildagliptin에 의한 최대의 혈당 강하 효과는 약물 투여 후 24주-30주 정도에 관찰되었고, vildagliptin 50 mg 1일 2회 요법은 rosiglitazone 8 mg 1일 1회, acarbose 100 mg 1일 3회와 혈당 강하 효과가 유사하였다.
vildagliptin은 설포닐유리아, 메트폴민, thiazolidinedione, 인슐린 치료와 병용 시 각각 당화혈색소 0.6, 0.9, 1.0, 0.5%의 부가적인 혈당 강하 효과가 있었다.
메트폴민만으로 혈당 조절이 불충분한 환자에서 추가적으로 투여할 경우 vildagliptin과 pioglitazone은 당화혈색소 1.0% 정도를 감소시키는 비슷한 효과를 보였다. 여러 임상 연구에서 vildagliptin 역시 위장관계 부작용은 증가하지 않았으나 요로감염이 증가하는 것으로 보고되었다.
가장 최근에 임상에서 쓰이기 시작한 경구당뇨병치료제인 sitagliptin과 vildagliptin은 서양인에 비해 일본, 중국 등 동양인에서 효과가 더 좋은 것으로 나타나 흥미롭다.
동물실험에서 GLP-1이 보인 베타 세포 보호 및 베타세포 증가 효과가 DPP-4 억제제에 의해서 인체에서도 나타날지, 장기간의 DPP-4 억제제의 치료가 당뇨병 환자의 치료에서 지속적인 효과를 나타낼지, 심혈관계에 미치는 영향은 어떠할 지 등에 대한 많은 관심이 있으며 이에 대한 연구 결과를 지켜보아야 할 것으로 생각된다.
Optimal combination regimen of incretin-based therapy with current treatment
American Diabetes Association과 European Association for the Study of Diabetes에서 제시하는 제2형 당뇨병 치료지침은 당뇨병 진단 시 생활습관 개선과 metformin 사용을 가장 먼저 권고한다.
생활습관 개선과 metformin만으로 목표혈당에 도달하지 못한 경우 sulfonylurea를 추가하거나, 덜 입증된 치료방법으로 pioglitazone 또는 glucagon-like peptide (GLP)-1 작용제(agonist)와 병합치료도 언급은 하고 있으나, 가장 강조하는 것은 인슐린을 이용한 병합치료이다.
그러나 현실적으로 인슐린을 조기에 사용하기에는 어려운 점이 많고, 최근 incretin과 관련된 약제들이 개발되면서 이들을 이용한 병합치료 또는 이들을 초기치료로 이용하자는 주장도 제기되고 있다.
Increatin 유사제(mimetic; GLP-1 작용제) 및 증강제(enhancer; dipeptidyl-peptidase [DPP]-4 억제제)들은 췌장 베타세포에 대한 보호효과를 가지고 있는 것으로 생각되어, 비교적 초기(베타세포 회복의 reversibility가 남아 있는)의 제2형 당뇨병 환자에게 사용하는 것이 이상적일 수 있다.
특히 metformin이 GLP-1의 합성과 분비를 증가시킨다고 보고되어, metformin 단독치료에 비해 metformin과 DPP-4 억제제의 병합요법이 당뇨병의 초기치료로 이상적일 수 있음이 조심스럽게 점쳐지고 있다.
실제 metformin과 DPP-4 억제제의 병합요법은 각각의 단독치료에 비해 혈당감소 효과가 더 우수하였고, DPP-4 억제제는 베타 세포 기능도 호전시켰다.
또한 pioglitazone에 DPP-4 억제제를 병합할 경우에도 저혈당 위험 없이 우수한 혈당조절 효과가 관찰되었다.
그에 비해 sulfonylurea와 DPP-4 억제제의 병합요법은 제한적인 것으로 생각되고 있는데, 그 이유는 sulfonylurea만으로 충분히 혈당조절이 되지 않은 환자들에게 DPP-4 억제제의 추가는 기존의 다른 약제들(pioglitazone 또는 metformin)을 추가하는 경우에 비해 혈당조절이 더 우수하지는 못했기 때문이다.
또한 sulfonylurea와 metformin 병합요법에 실패한 경우 DPP-4 억제제를 추가하는 삼제요법도 thiazolidinedione (TZD)을 추가한 삼제 병용치료나 basal insulin을 투여하는 방법에 비해 혈당조절 효과가 우수하지는 못했다.
그러나 metformin, TZD, 및 DPP-4 억제제의 삼제 병합요법은 다른 삼제 병합방법들에 비해 많은 장점을 가질 것으로 생각된다. Metformin과 TZD의 인슐린저항성 개선, pioglitazone의 심혈관 보호작용, sulfonylurea에 비해 DPP-4 억제제의 베타세포 기능 강화 효과는 이들 삼제 병용치료가 이론적으로 가장 이상적인 조합이 될 수 있음을 추정케 한다.
GLP-1 작용제는 경구혈당강하제의 병합요법으로 혈당조절이 되지 않는 환자에서 인슐린을 대체할 수 있는 약제가 될 수 있다. 최근 metformin과의 병합, metformin 및 rosiglitazone에 추가하는 경우 혈당조절 이외에 체중감소, 혈압조절에도 도움이 된다고 보고되었다.
그러나 부작용으로 인해 상당수(약 10%)의 환자들이 GLP-1 유사제에 순응하기 어렵고, 베타세포 기능이 많이 저하된 경우 혈당감소효과가 충분하지 않을 수 있다. 아직 연구된 바는 없지만, GLP-1 유사제와 인슐린의 병합치료도 체중증가 없이 추가적인 혈당조절 효과를 기대할 수 있다.
최근 TZD의 안정성에 대한 문제가 제기된 상황에서 incretin 관련 약제들은 제2형 당뇨병 환자 치료에 많은 도움이 될 수 있다.
그러나 위에 언급한 여러 가지 병합치료의 근거로는 incretin 관련 약제들이 베타세포의 기능을 유지하고 보호한다는 것인데, 당뇨병 환자들에서 직접적인 방법으로 베타세포 기능 호전을 입증한 연구는 거의 없는 실정이다.
따라서 incretin 관련 약제들의 베타세포 기능에 대한 보호효과, 장기간의 혈당강하 효과, 감염 등을 비롯한 안정성에 대한 연구들이 필요하며, 이러한 연구결과를 바탕으로 이들 약제의 효과가 확실히 입증된다면 제2형 당뇨병 환자에서 incretin에 기초한 치료약제들을 이용한 치료전략의 재정립이 필요할 것이다.


